يتم عرض قوانين الغازات بويل و شارل و جاي لوساك و أفوجادرو للوصول منها لصيغة عامة تجمع هذه القوانين و الحصول على القانون العام للغازات. و يتم أيضا توضيح ماهو الثابت العام للغازات.
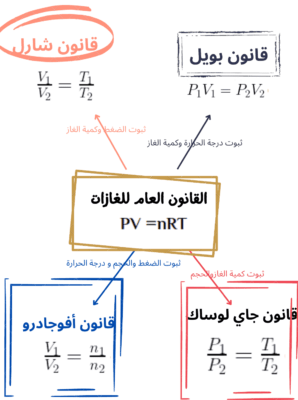
لتحديد خصائص كمية من الغاز يجب تحديد حجمها V ودرجة الحرارةالكلفينية (على مقياس كلفن) T والضغط P و عدد مولاتها n (عدد الجزيئات N). تم إجراء تجارب لتحديد العلاقات بين هذه الكميات للحالة الغازية. تحديد قد تم تغيير متغير حالة واحد و النظر لأخر ماذا يحدث له عند ثبات باقي العوامل. مثل دراسة العلاقة بين الضغط P و الحجم V عند ثبوت باقي العوامل كما فعل بويل. و تم الحصول على قوانين كثيرة يراد تجميعها في قانون واحد و هو الذي يربط بين كل هذه المتغيرات و يسمى القانون العام للغازات. و القوانين هي
قانون بويل للغازات
- عند ثبوت كمية الغاز ودرجة الحرارة ، فإن الضغط والحجم يتناسبان عكسيا.
- PV = const أو
قانون شارل للغازات
- عند ثبوت كمية الغاز والضغط فإن الحجم يتناسب مع درجة الحرارة تناسبا طرديا.
- V/T = const أو
قانون جاي لوساك للغازات
- عند ثبوت كمية الغاز والحجم فإن الضغط يتناسب مع درجة الحرارة تناسبا طرديا.
- P/T = const أو
قانون أفوجادرو للغازات
- عند ثبات الحجم ودرجة الحرارة يتناسب الضغط مع كمية الغاز (عدد المولات) تناسبا طرديا.
- V/n = const أو
ملحوظة هامة :هذه التجارب تم إجرائها على الغازات الحقيقية و لكن في ظروف مثالية من درجة حرارة عالية وضغط منخفض نسبيا لذلك سميت القوانين بقوانين الغاز المثالي. و هي أيضا توافق قوانين النظرية الحركية للغازات التي بنيت على فرضية الغاز المثالي.
الجمع بين هذه التجارب و القوانين يعطي قانون الغاز المثالي ، معادلة واحدة تربط جميع المتغيرات الأربعة:
PV /nT = const
الثابت هو الكمية R هي الثابت العام للغازات. قيمته التي تم تحديدها تجريبياً هي (R = 8.315 J/(mol.K. أو تكتب كالأتي
PV =nRT
وعند ثبات كمية الغاز فإنه يمكن كتابة القانون كالأتي
PV/T = const
ثابت الغاز المثالي
- الثابت R لا يتوقف على نوع الغاز.
- ثابت من الثوابت الكونية و يساوي (R = 8.315 J/(mol.K.
- المعادلة صالحة للغاز المثالي فقط. أما في حالة الغازات الحقيقية تطبق تعديلات لهذا القانون.
- و يرتبط هذا الثابت بثابت بولتزمان K بالعلاقة الأتية
حيث NA عدد أفوجادرو.
تعريف القانون العام للغازات
هو قانون يربط بين كل المتغيرات للغاز من ضغط ودرجة حرارة و حجم و عدد مولات.